美国马萨诸塞大学阿默斯特分校科研团队近日宣布,一种基于纳米颗粒的新型疫苗在小鼠实验中成功预防多种侵袭性癌症,包括黑色素瘤、胰腺癌和三阴性乳腺癌。研究显示,根据癌种不同,最高可有88%的接种小鼠在整个试验期内始终未出现肿瘤,且该策略在多项试验中显著减少甚至完全阻止了癌症在体内转移。
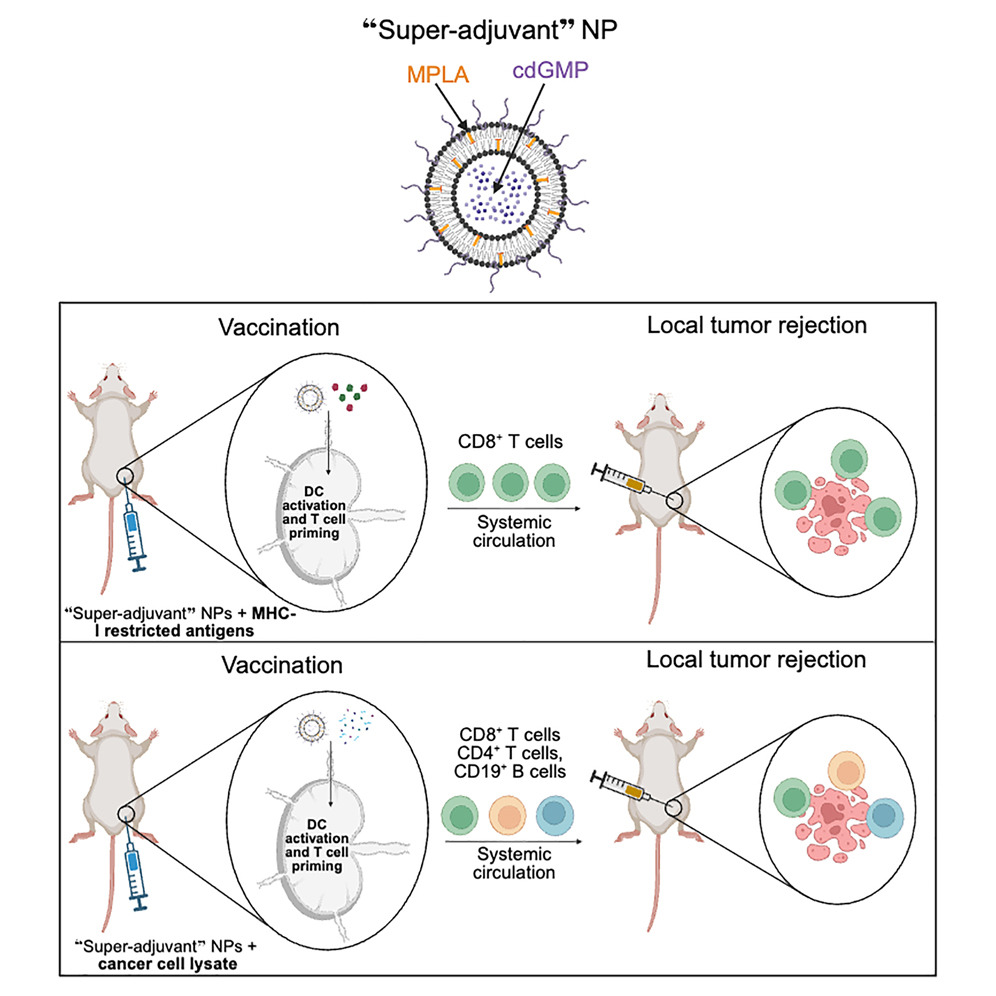
这款候选疫苗的核心是一种脂质纳米颗粒构成的“超佐剂”平台,可同时封装并稳定递送两种不同的免疫刺激分子,再与特定癌症抗原或来自肿瘤本身的“肿瘤裂解物”组合使用。研究团队介绍,这一设计模拟了病原体向免疫系统发出多重“危险信号”的方式,从而更有效地激活先天免疫细胞,推动它们高效呈递抗原并启动针对肿瘤的T细胞杀伤反应,同时建立持久的免疫记忆。
在研究的第一阶段,科研人员将纳米颗粒平台与已知的黑色素瘤肽段抗原配对,先为小鼠接种疫苗,三周后再注入黑色素瘤细胞模拟肿瘤挑战。结果显示,接受这种“超佐剂”纳米疫苗的小鼠中,有80%在长达250天的观察期内保持无瘤生存,而接种传统疫苗、非纳米配方或未接种的对照组则全部在35天内出现肿瘤并死亡。同时,在模拟血行播散转移的实验中,接种纳米疫苗的小鼠肺部未出现转移灶,而所有对照动物肺部均发现明显肿瘤结节,凸显其在阻断转移环节的潜力。
研究负责人、该校生物医学工程系助理教授Prabhani Atukorale指出,团队将这种保护形容为“记忆免疫”,其优势在于免疫记忆并不局限于某一部位,而是遍布全身,从而对未来可能出现的癌细胞保持长期巡逻和警戒。她此前的相关工作已证明,类似的纳米药物设计能够缩小甚至清除小鼠体内既有的胰腺肿瘤,而本次则进一步表明同一平台也可作为预防性疫苗使用,在肿瘤形成之前就构筑防线。
不过,为每一种癌症开发专门的抗原往往需要复杂而昂贵的基因测序和生物信息学分析。为克服这一障碍,团队在第二阶段尝试采用来源更为直接的“肿瘤裂解物”作为抗原,即将已被杀死的癌细胞整体成分与纳米“超佐剂”结合制成疫苗,并在小鼠中测试其针对黑色素瘤、胰腺导管腺癌和三阴性乳腺癌的防护效果。结果令人瞩目:在胰腺癌模型中,88%的接种小鼠拒绝了肿瘤形成;在乳腺癌模型中这一比例为75%,黑色素瘤模型则为69%。所有在初次挑战中保持无瘤的接种小鼠,在随后再次被系统性注入癌细胞时,同样表现出对转移的强烈抵抗能力。
论文第一作者、该校博士后研究员Griffin Kane表示,强而有力的肿瘤特异性T细胞应答,是延长生存和防止复发的关键。该纳米平台之所以能显著增强T细胞反应,在于其解决了许多有前景的免疫佐剂之间“水火不容”的配伍难题:在传统制剂中,多种免疫刺激分子常因分子性质差异难以稳定共存,而脂质纳米颗粒则能够像“载体舱”一样,将不同佐剂共同封装并协调释放,从而实现多通路的先天免疫激活与高效抗原呈递。
研究人员认为,这一纳米颗粒系统为构建可适配多种癌症的“平台型”疫苗提供了坚实基础,未来既有望用作治疗性癌症疫苗,帮助已确诊患者控制病情、降低复发和转移风险,也可能为高危人群提供预防性免疫方案。围绕这一核心技术,Atukorale和Kane共同创立了初创公司 NanoVax Therapeutics,致力于推动该平台向临床转化,完成安全性和有效性方面的“去风险化”验证,并拓展到更多癌种和治疗场景。
相关研究已发表于期刊《Medicine》,论文题为《Super-adjuvant nanoparticles for platform cancer vaccination》。团队目前计划在现有基础上进一步开发治疗性癌症疫苗,并已着手开展早期转化研究。研究人员同时强调,这一进展依赖于校内生物医学工程系、应用生命科学研究院及合作医学院等多个机构的支持,多学科交叉是推动纳米免疫技术从实验室走向临床的关键。

